Unser Anspruch: Qualität & Innovation!
Mit unserem Bereich Forschung & Entwicklung leisten wir einen Beitrag zur Entwicklung von qualitativ hochwertigen in vitro Diagnostika und unterstützen unsere Partner mit Produkten und qualifiziertem Know-how.
Plattformübergreifende Testsysteme & Kontrollproben
Wir entwickeln in vitro Diagnostika (IVD) in Form von Testsystemen und Kontrollproben mit CE-Kennzeichnung. Dabei arbeiten wir plattformübergreifend, von ELISA Kits über Schnelltests bis hin zu Automaten.
Zusätzlich zu unseren eigenen Entwicklungen arbeiten wir auch mit Partnern aus der Wissenschaft und der pharmazeutischen & diagnostischen Industrie zusammen, sowohl im humanen als auch im veterinären Bereich.
Für uns definiert sich die Güte einer Entwicklung maßgeblich durch die Qualität der eingesetzten Proben. Dies können wir durch unsere Kompetenz auf dem Gebiet der Bereitstellung von humanen Biomaterialien abbilden.
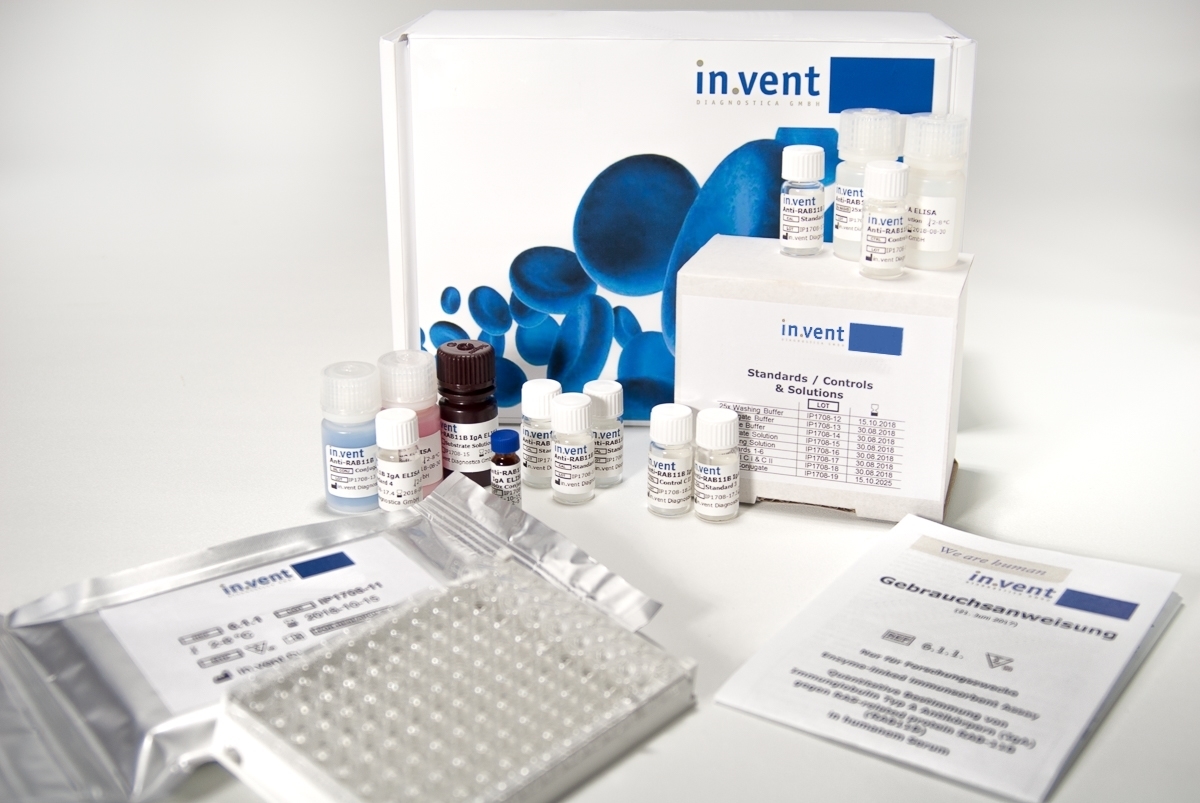
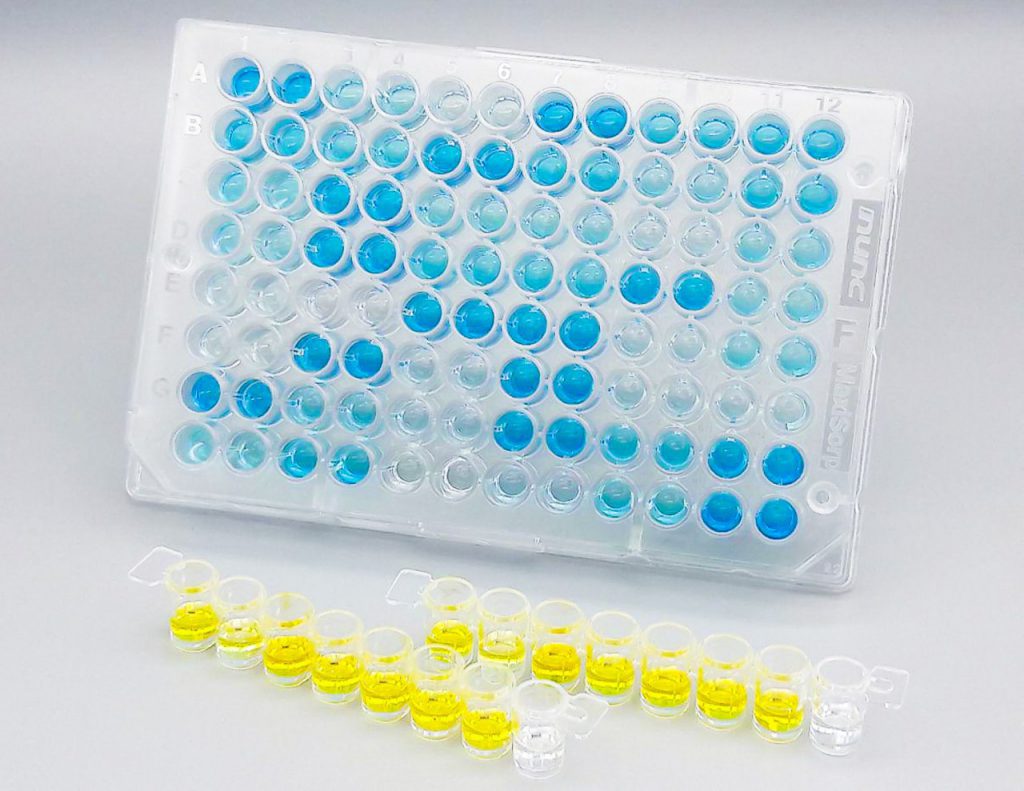
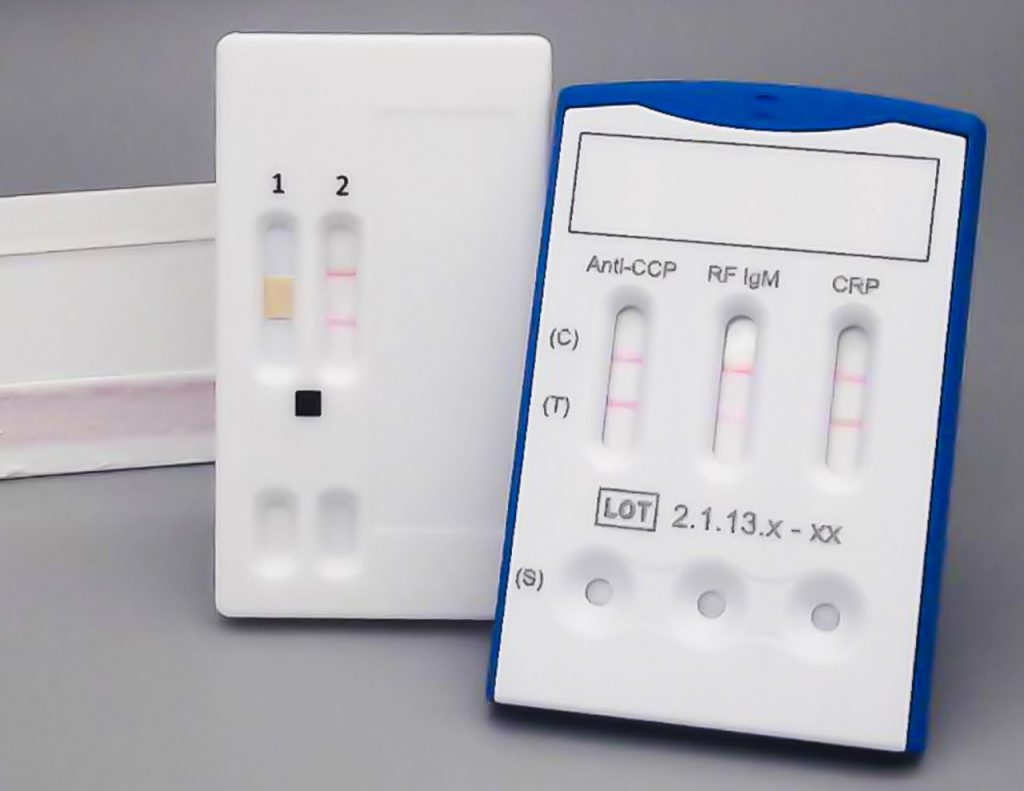
Von Autoimmunität bis Onkologie
Durch die Zusammenarbeit mit dem Diagnostik Netzwerk Berlin-Brandenburg (e.V.) können wir den gesamten Produktzyklus von der Machbarkeitsstudie bis zum CE gekennzeichneten IVD abdecken.
So konnten wir bereits zahlreiche Projekte umsetzen, die in der Routine-Diagnostik sowie bei Therapieentscheidungen Anwendung finden, z. B. für den Erkrankungsbereich Autoimmunität, der Bestimmung von kleinen Molekülen und dem Monitoring im Bereich Novel Food / Nutritionals.
Ringversuche & Kit-externe Kontrollproben
Bei den Kontrollproben unterstützen wir zum einen viele europäische Ringversuchsanbieter, um die Labor-übergreifende Qualitätskontrolle zu gewährleisten. Zum anderen bieten wir die Entwicklung und Herstellung von Kit-externen und herstellerunabhängigen Kontrollproben an, die in der Laborroutine Anwendung finden.
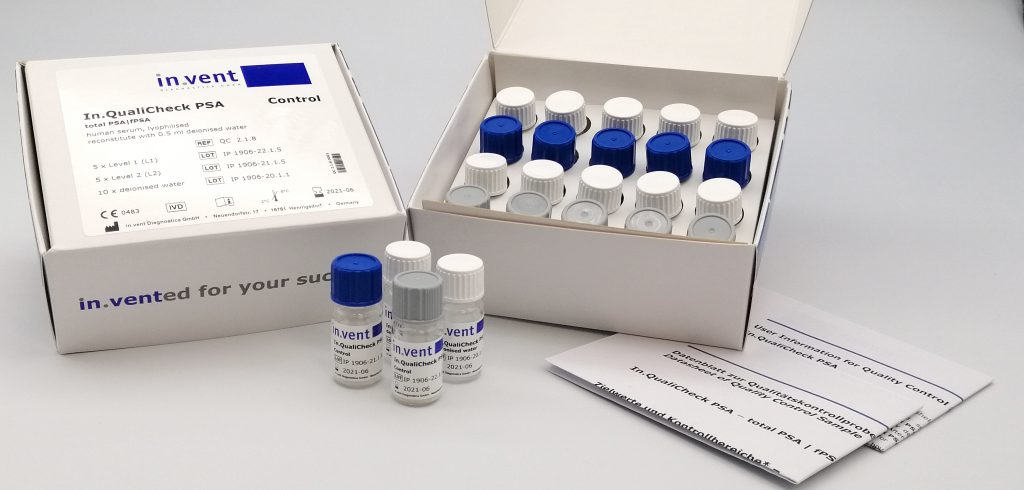
Immunoassays – vom PoC bis zum Automaten
Im Bereich der Testsysteme beschäftigen wir uns im Speziellen mit Immunoassays. Diese grenzen sich z. B. von chemischen Reaktionsverfahren, wie die Jaffé-Reaktion zum Nachweis von Kreatinin oder der Messung der Erythrozytensedimentationsrate, ab.
Der typische Vertreter der Immunoassays ist der ELISA (Enzyme-linked Immunosorbent Assay). Dieser besteht meist aus zwei Antikörpern, die ein Antigen in der Probe durch die Bildung eines Sandwich-Komplexes binden und durch eine enzymatische Farbreaktion quantifizierbar machen.
Abweichend von diesem besteht auch die Möglichkeit eines kompetitiven Testaufbaus. Statt Antikörper können auch Antigene verwendet werden, um Antikörper in der Probe nachzuweisen. Für diesen Nachweis kommen neben enzymatisch-kolorimetrisch u. a. Markierungen mit Lumineszenz, Latex- oder Gold-Partikel zum Einsatz.
Bei Automatensystemen werden, ganz allgemein gesprochen, die manuellen Schritte von einem typischen ELISA durch einen Pipettierautomaten übernommen und so die Auswertung automatisch durchgeführt. Eingesetzt werden diese Automaten vorrangig in medizinisch-diagnostischen Routine-Laboren, sodass eine große Anzahl an Patientenproben bearbeitet werden kann.
Für diagnostische Parameter bei denen die Zeit zwischen Probenentnahme und Ergebnis entscheidend für den Patienten sind, kommen Schnelltests (Point of Care (PoC) Tests), z. B. in Form von Lateral oder Vertical Flow Systemen zum Einsatz. Bei den Immunoassay-Schnelltests ist der Aufbau ähnlich wie beim ELISA, wobei für die Markierung typischerweise kolloidales Gold verwendet wird, um eine optische Auswertung zu ermöglichen.
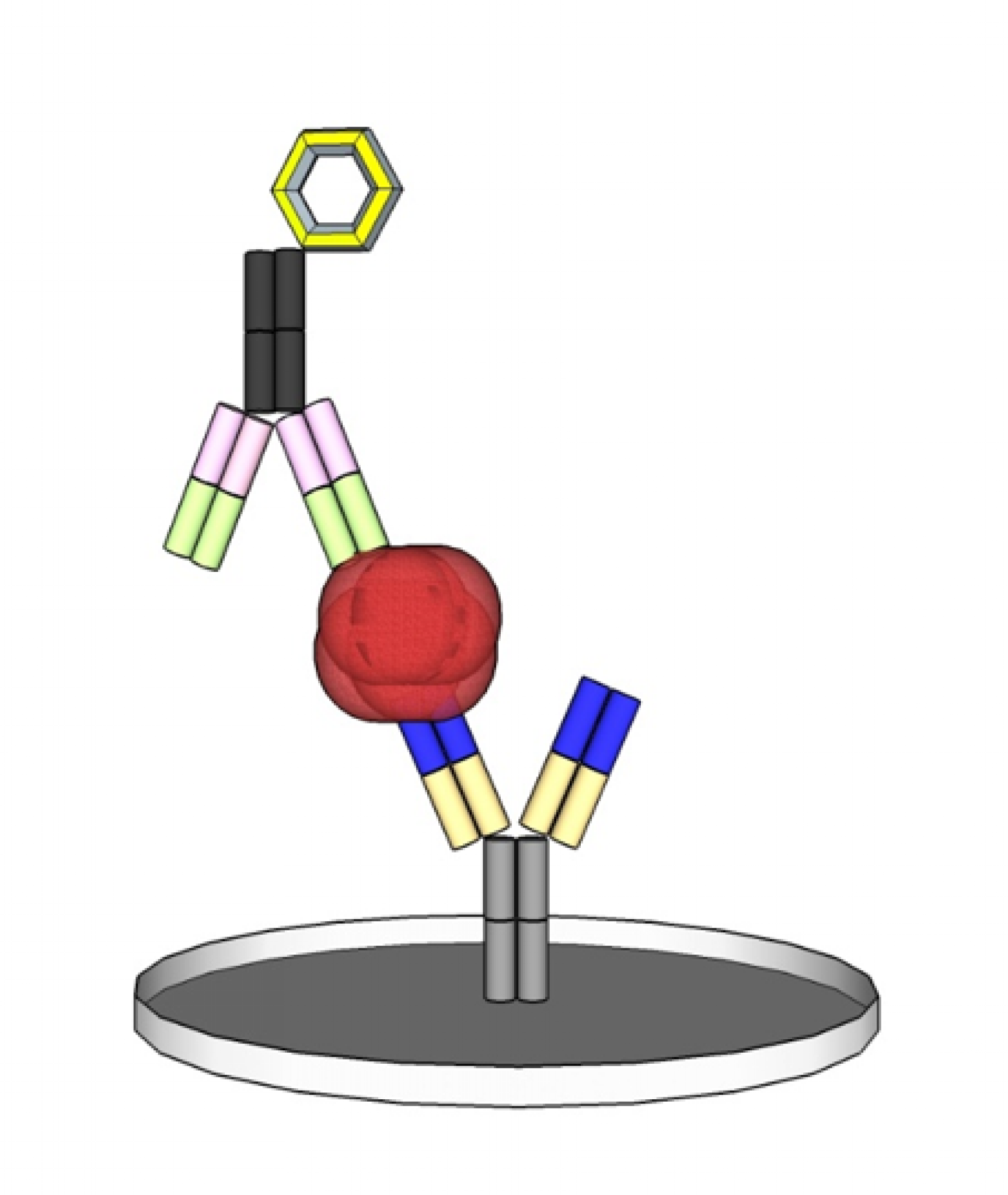
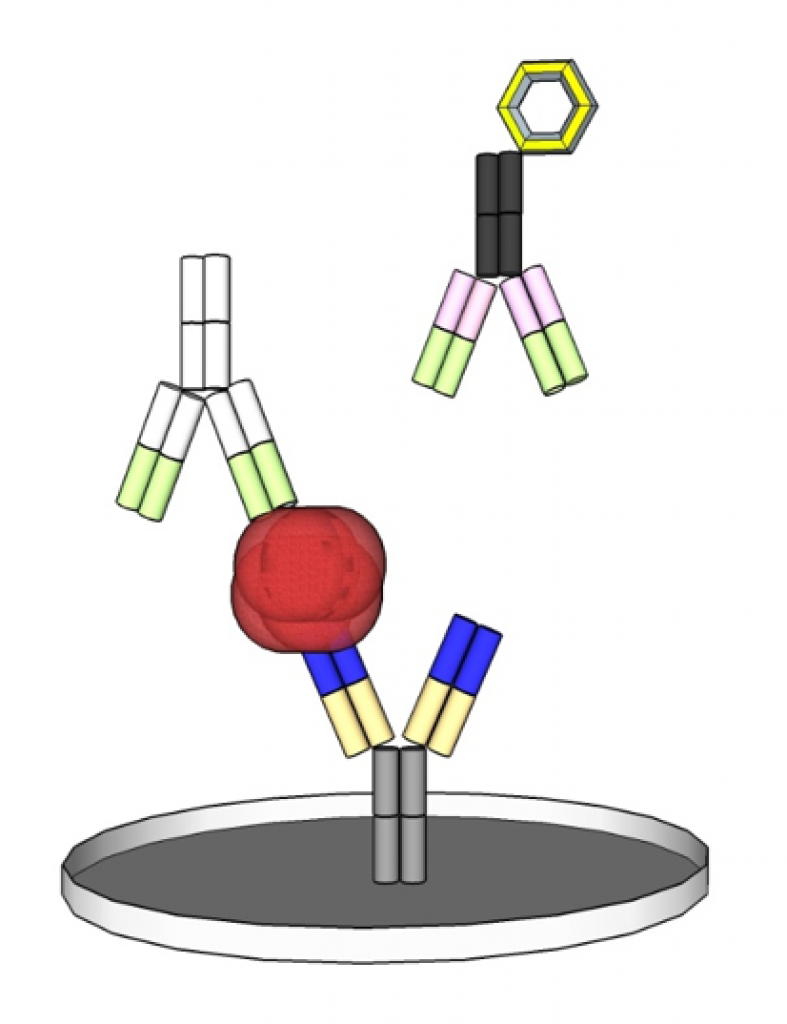
Der gesamte Produktzyklus eines IVD
Die Entwicklung eines IVD beginnt mit der Projektidee und –einschätzung inkl. Anforderungsprofil, gefolgt von der Machbarkeitsstudie (Feasibility). In dieser wird untersucht, ob die gestellten Anforderungen grundsätzlich erfüllt werden können. Zum Beispiel, ob der Messbereich mit den gewählten Rohstoffen und Testsystem erreicht werden kann. Anschließend werden die nun grob-definierten Rahmenbedingungen in der eigentlichen Produktentwicklung & -optimierung feiner eingestellt.
Im Transfer-to-Production wird der Maßstab des Herstellungsprozesses vergrößert (Scale-up). Zudem wird die Wiederholbarkeit geprüft, sodass es sich zum Abschluss dieser Phase um ein serienreifes Produkt handelt und der Prozess geregelt, kontrolliert und auditfähig ist.
Bei der abschließenden Leistungsbewertungsprüfung wird die Erfüllung der zu Beginn definierten Anforderungen beurteilt, z. B. in Form von Präzision, Homogenität, Sensitivität, Wiederfindung und klinischer Leistungsfähigkeit. U. a. gehören diese Daten in die Technische Dokumentation, die die Grundvoraussetzung für die Zulassung, der Erlangung der CE-Kennzeichnung und Markteinführung eines IVD ist. Um die Qualität nach dem Inverkehrbringen zu bewerten, schließt sich die Marktbeobachtung (Post-market surveillance) an. Die daraus resultierenden Erkenntnisse können dazu führen, dass das Produkt angepasst werden muss, sodass der Produktzyklus von neuem beginnt.

Human- und Veterinär Diagnostik
Das Credo einer präzisen und frühzeitigen Diagnose als beste Voraussetzung für eine erfolgreiche Therapie existiert schon lange und hat in Hinblick auf den demografischen Wandel, der steigenden Anzahl an chronischen Erkrankungen und Krebs-Diagnosen nicht an Relevanz verloren.
Schilddrüsenerkrankungen, wie Hashimoto und Morbus Basedow, sind Autoimmunerkrankungen, bei denen der Körper Antikörper gegen körpereigene Proteine bildet. Diese nachgewiesenen sogenannten Autoantikörper können für die Diagnose herangezogen werden.
Eine andere Autoimmunerkrankung ist Rheumatoide Arthritis, für deren Diagnose bekannte Biomarker wie Rheumafaktoren und Antikörper gegen cyclisch-citrullinierte Peptide genutzt werden. Da es bisher keine Heilung für diese chronische Erkrankung gibt, ist die Wissenschaft weiterhin auf der Suche nach neuen Biomarkern, die eine frühzeitige Diagnose ermöglichen.
Auch im Bereich der Immun-Onkologie beschäftigen sich viele Forschungsansätze mit der Suche nach neuen Möglichkeiten für die Diagnose und Prognose sowie des Therapie-Monitorings der Erkrankung.
Bei Autoimmunität steht die Messung von Autoantikörpern im Vordergrund, bei anderen Krankheitsbildern werden hingegen kleine Moleküle nachgewiesen. So können bei degenerativen Erkrankungen, wie Osteoarthrose, die Abbaufragmente für die Diagnostik genutzt werden. Zum Teil stehen die sensitivsten Biomarker nicht im offensichtlich-kausalem Zusammenhang mit der Erkrankung, das bekannteste Beispiel ist dabei wohl Procalcitonin bei Sepsis.
Neben der klassischen Diagnostik und Therapie bei bekannten und neuen Krankheitsbildern, gewinnen Novel Food, Nutraceuticals, Functional Food, etc. im Gesundheitssektor an Bedeutung. Es handelt sich dabei meist um Lebensmittel mit gesundheitsfördernden Eigenschaften, z. B. Chia-Samen, Noni-Saft und Stevia.
Für mehrere der aufgeführten Bereiche haben wir sowohl Testsysteme als auch Kontrollproben entwickelt und sind in der aktiven Kooperation mit Wissenschaft und Industrie, um unseren Beitrag zu einer qualitativ hochwertigen Diagnostik zu leisten. Zur Identifikation neuer Biomarker arbeiten wir auch mit engine the biomarker company zusammen. Mit der dort angebotenen Technologie können in einem Schritt über 100.000 potenzielle Antigene analysiert werden.
Da im Veterinär-Bereich dieselben Grundsätze wie in der Humandiagnostik & –medizin gelten, erweitern wir unser Produktportfolio auf Biomaterialien tierischen Ursprungs und arbeiten gemeinsam mit den Partnern aus dem Diagnostik Netzwerk Berlin Brandenburg (e.V.) an Projekten zur biomarkerbasierten Osteoarthrose-Diagnostik bei Hunden & Pferden sowie der Entwicklung von Veterinär-Kontrollproben.




